
Introdução
A recente pandemia de covid-19, resultou em uma crise de saúde global sem precedentes¹. Felizmente, a corrida para o desenvolvimento acelerado de vacinas permitiu uma estratégia de enfrentamento para a retomada das atividades usuais em todas as faixas etárias, mas não sem antes trazer outros desafios consigo, especialmente a desconfiança relacionada à segurança dos imunizantes utilizados no combate ao SARS-CoV-2²,³. Essa revisão tem o objetivo de apresentar a trajetória do desenvolvimento das vacinas covid-19, atualizar sobre os dados de segurança das vacinas que utilizam a plataforma de RNA mensageiro (mRNA) em pediatria, e as recomendações atuais do Programa Nacional de Imunizações (PNI) para o público infantil e de adolescentes.
História
O desenvolvimento das vacinas covid-19 foi essencial para o enfrentamento da pandemia, tendo permitido a prevenção de quase 20 milhões de óbitos em todo o mundo apenas no primeiro ano de vacinação⁴. Este desenvolvimento acelerado foi possível graças a diferentes fatores, onde cabe destacar o conhecimento prévio acumulado ao longo de décadas de estudos em vacinas⁵.
Diferentes plataformas tecnológicas foram testadas e desenvolvidas com vacinas contendo vírus vivo atenuado ou inativado; vacinas baseadas em proteína (subunidades da proteína viral ou partículas semelhantes ao vírus); vacinas com vetor viral; e vacinas baseadas em ácidos nucleicos (DNA e RNA)²˒⁶.
A plataforma de vacinas RNA mensageiro (mRNA), por exemplo, já estava sendo desenvolvida há mais de 30 anos para outros patógenos. E com a necessidade global de salvar vidas em tempo hábil, investimentos da comunidade científica, e financeiros, foram priorizados para que essa tecnologia fosse utilizada para a produção de vacinas covid-19, respeitando todas as etapas de estudos pré-clínicos e clínicos (fases 1, 2 e 3) para sua posterior aprovação e administração na população⁷˒⁸. (Figura 1)
Figura 1. Cronologia de desenvolvimento de uma vacina mRNA.
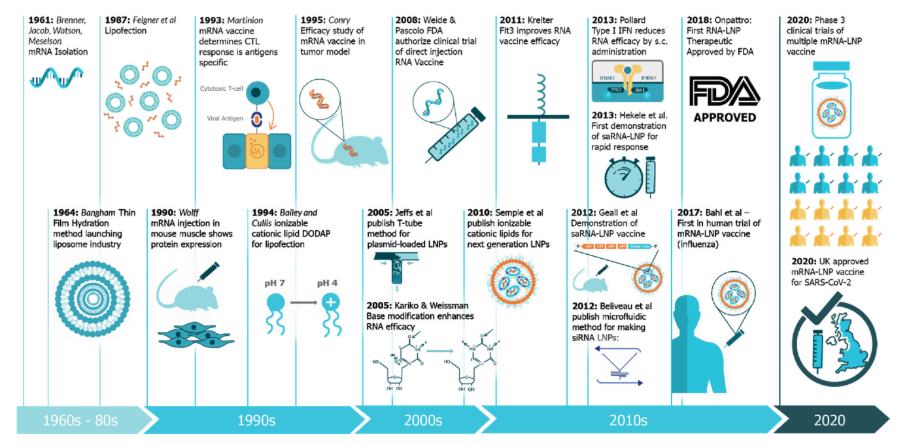 CTL, linfócito T citotóxico; DODAP, 1,2-dioleoil-3-dimetilamônio-propano; FDA, Agência de Administração de Alimentos e Medicamentos dos EUA; Flt3, tirosina quinase 3 semelhante a Fms; IFN, interferon; LNP, nanopartícula lipídica; saRNA, RNA autoamplificador; SC, subcutâneo.
CTL, linfócito T citotóxico; DODAP, 1,2-dioleoil-3-dimetilamônio-propano; FDA, Agência de Administração de Alimentos e Medicamentos dos EUA; Flt3, tirosina quinase 3 semelhante a Fms; IFN, interferon; LNP, nanopartícula lipídica; saRNA, RNA autoamplificador; SC, subcutâneo.
Adaptado de: Blakney KA et al. (2021)⁷.
Uma importante vantagem de plataformas que se baseiam em mRNA é a rapidez com que as vacinas podem ser desenvolvidas, uma vez que essas moléculas podem ser sintetizadas num processo que não depende de culturas virais ou de fermentação, podendo, inclusive, serem atualizadas rapidamente de acordo com as variantes em circulação⁹.
Presente
Embora a vacinação tenha sido a estratégia fundamental que modificou as curvas epidemiológicas com reduções substanciais nas hospitalizações e óbitos na população vacinada, bem como a existência de uma vasta literatura científica e monitoramento da farmacovigilância em vacinas administradas no público infantil e adolescente, ainda há dúvidas e questionamentos acerca da segurança das vacinas disponíveis¹⁰˒³.
No mundo já foram administradas mais de 13 bilhões de doses de vacinas covid-19 em distintas plataformas tecnológicas, sendo somente no Brasil mais de 520 milhões de doses¹¹. Só no ano 2022 foram administradas 10.347.706 doses da vacina covid-19 Pfizer pediátrica. Dados do painel "vacinômetro covid" demonstram que cerca de 15% de todas as vacinas administradas no país são referentes ao público acima de 6 meses e abaixo de 18 anos¹².
Sabe-se que o público infantil (em especial abaixo de 2 anos) e os maiores de 80 anos constituem os principais grupos com maiores taxas de hospitalização por covid-19 no Brasil. Só as hospitalizações já seriam suficientes para justificar estratégias de prevenção para esses grupos vulneráveis, mas pode-se adicionar outros desfechos clínicos com impactos negativos ao público pediátrico como: covid longa e suas repercussões em distintos sistemas, Síndrome Inflamatória Multissistêmica Pediátrica (SIM-P), evento raro e extremamente grave e por fim, o óbito¹³,¹⁴.
Segurança
Em boletim de monitoramento contínuo das vacinas administradas pelo PNI para o público abaixo de 10 anos de idade, observou-se um coeficiente de incidência de Eventos Supostamente Atribuíveis à Vacinação e Imunizações (ESAVI) variando entre 3,4 a 58 por 100 mil doses administradas para todas as vacinas pediátricas somente no ano de 2022 (Tabela A)¹⁵ — sendo o menor coeficiente observado para a vacina contra o HPV e o maior para a vacina contra o rotavírus.
Tabela A. Coeficiente total de ESAVI em crianças até 10 anos, segundo ano de notificação – Brasil, 2018 a 2022*
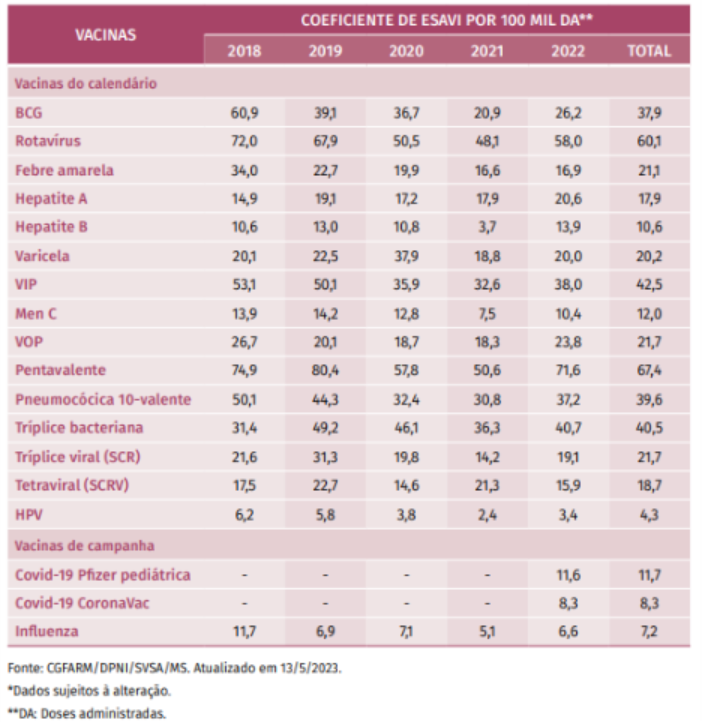 Adaptado de: Saúde Brasil (2023)¹⁵.
Adaptado de: Saúde Brasil (2023)¹⁵.
Em relação à todas as vacinas, foram administradas 408.357.948 doses em crianças de até 10 anos no Brasil, entre 2018 a 2022. Sobre as notificações de casos de ESAVI grave que evoluíram ao óbito (n=231), observa-se que 22 (9,5%) foram classificados como tendo relação causal consistente (A1), 116 (50,2%) foram considerados reações coincidentes ou inconsistentes (C), 24 (10,4%) foram inclassificáveis e 52 (22,5%) ainda permanecem em investigação – não encerrado¹⁵.
Após revisão realizada pela esfera federal do sistema de vigilância, dos 22 casos que evoluíram ao óbito classificados como A1 pelas vigilâncias estaduais, apenas 5 (22,7%) permaneceram com relação causal consistente (A1), 2 (9,1%) apresentaram dados da investigação conflitantes em relação à causalidade (B2), 2 (9,1%) foram classificados como reações coincidentes ou inconsistentes (C) e 4 (18,2%) foram inclassificáveis (D). Observou-se ainda que nove óbitos foram classificados erroneamente com esse desfecho (40,9%). Assim, cinco óbitos com relação causal consistente com a vacinação (A1) representaram menos de dois óbitos em cada 100 milhões de doses administradas no período analisado¹⁵.
Tabela B. Descrição dos óbitos por ESAVI grave revisados, segundo classificação de causalidade e diagnóstico sindrômico – Brasil, 2018 a 2022 (N=13)*
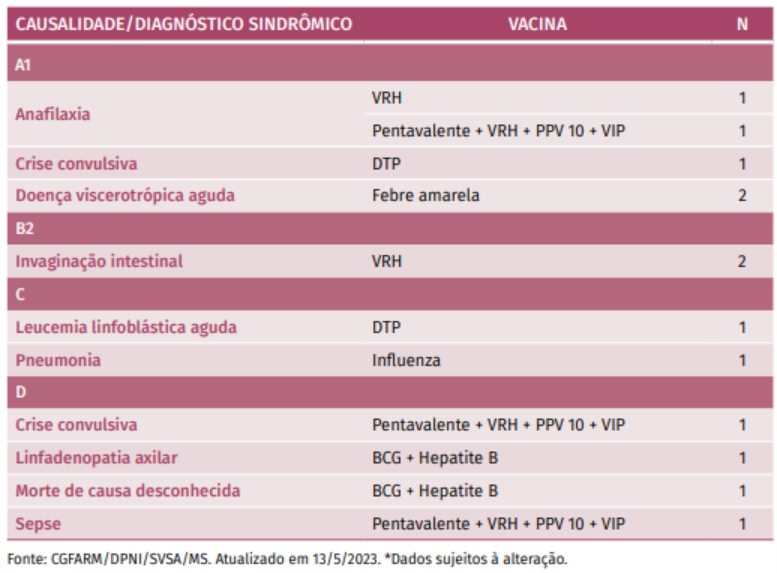
Toda esta análise contínua de dados ratifica a segurança das vacinas do calendário infantil do PNI, incluindo as vacinas covid-19.
Adaptado de: Saúde Brasil (2023)¹⁵.
Os ESAVI mais comuns (em cerca de 10% dos pacientes) relacionados às vacinas covid-19 mRNA são: cefaleia, artralgia, mialgia, inapetência, sonolência, diarreia, dor e edema no local de administração, fadiga, calafrios e febre, cuja duração é autolimitada, ou seja, há regressão usual desses eventos em até 72 horas. Entretanto, há ESAVI graves raros descritos que permeiam dúvidas e discussões na sociedade e que precisam ser compreendidos para poder apoiar decisões de pais e/ou responsáveis para vacinarem seus filhos¹⁶,¹⁷,¹⁸.
Após a aprovação e uso em larga escala, estas vacinas vêm sendo monitoradas nos estudos de fase 4, que, à semelhança de todos outros medicamentos e vacinas em uso, são realizados durante toda a vida do produto enquanto estiver sendo comercializado¹⁹.
Apenas nos estudos de fase 4 é que se torna possível a identificação de eventos raros (0,01% a 0,10%) e muito raros (< 0,01%), uma vez que requerem uma amostragem populacional de dezenas de milhares a centenas de milhares para serem detectados²⁰. Nos estudos de fase 4 das vacinas covid-19 mRNA foi identificada a ocorrência de raros casos de miocardite e pericardite, especialmente em adolescentes e adultos jovens do sexo masculino. A incidência de casos de miocardite após vacinação de mRNA covid-19 na população em geral é muito baixa, sendo detectados em estudos realizados em Israel e Estados Unidos numa frequência de 0,3–5 por 100.000 pessoas vacinadas²¹. Importante destacar que, nos casos raros de miocardite ou pericardite observados em adolescentes e adultos jovens após a vacinação com vacinas de mRNA, a maioria apresentou boa resposta ao tratamento e repouso, com recuperação geralmente em poucos dias ou semanas²¹. Esta evolução benigna contrasta com os casos de miocardite pós-viral ou mesmo a miocardite relacionada à SIM-P pós-covid-19, que, no geral, tem maior gravidade e apresentam riscos importantes de sequelas ou mesmo óbito²¹,²².
Um estudo realizado no Reino Unido demonstrou que, entre os indivíduos infectados pelo SARS-CoV-2, o risco de desenvolver miocardite foi menor entre os vacinados — passando de 3,5 para 2,3 casos a cada 100.000 infectados, em comparação com aqueles que não haviam recebido a vacina. Isso significa que a despeito do raro risco da miocardite pós-vacina (cerca de 0,2 casos por 100.000 doses aplicadas) os benefícios superam os eventuais riscos, ou seja, a vacina previne mais casos de miocardite a longo prazo do que cause no curto prazo²³.
Outro estudo britânico envolvendo 5,1 milhões de crianças revelou que a infecção por SARS-CoV-2 aumentou o risco de hospitalização para sete desfechos, incluindo síndrome inflamatória multissistêmica e miocardite. No entanto, estes riscos estavam ausentes ou reduzidos em crianças vacinadas antes da infecção²⁴.
Um estudo realizado no Canadá avaliou a relação entre o intervalo entre doses das vacinas de mRNA (Pfizer e Moderna) e a ocorrência de miocardite e/ou pericardite em pessoas com 12 anos ou mais. Os resultados indicaram que a taxa desses eventos foi maior entre aqueles que receberam a segunda dose com um intervalo igual ou inferior a 30 dias em comparação com os que aguardaram 56 dias ou mais (353 vs. 103,2 casos por milhão de doses aplicadas)²⁵.
Desde o início da imunização pediátrica no Brasil o PNI adotou a recomendação de espaçamento entre as doses em oito semanas o que corroborou com os dados de segurança das vacinas utilizadas e continuamente monitoradas no país²⁶. Segundo o documento da Sociedade Brasileira de Pediatria (2023), os casos de miocardite e pericardite associados às vacinas de mRNA foram raros, geralmente leves e com boa evolução clínica, especialmente entre adolescentes e adultos jovens. Não foram relatados óbitos relacionados a esses eventos nessa população, o que contribui para refutar a hipótese de associação entre vacinação e morte súbita em indivíduos previamente saudáveis.
A avaliação de risco-benefício é um princípio fundamental em saúde pública. Embora o estudo de Liko e Cieslak (2024) não discuta esse conceito diretamente, seus achados reforçam essa lógica ao demonstrar que, entre 1.292 mortes de jovens de 16 a 30 anos no Oregon, nenhuma foi atribuída à vacinação com mRNA, e os dados não sustentam uma associação com morte súbita cardíaca. Assim, os autores concluem que a vacinação continua sendo recomendada para prevenir complicações e mortes por COVID-19²⁸.
Recomendações atuais e vacinas disponíveis
A partir de 2024 o PNI recomenda, em seu calendário de vacinação na rotina, a vacinação contra a covid-19 (Tabela C) de todas as crianças a partir de 6 meses a menores de 5 anos de idade, no esquema primário de duas ou três doses, a depender do fabricante, sem necessidade de doses de reforço nos anos subsequentes e acima dessa faixa etária apenas crianças e adolescentes com algum imunocomprometimento e/ou outra situação específica (Ex: indígena, quilombolas, adolescente gestante e outros) tornam-se elegíveis para a vacinação²⁹,³⁰.
Tabela C. Público Elegível para realizar a vacinação covid-19 em 2025²⁹,³⁰.
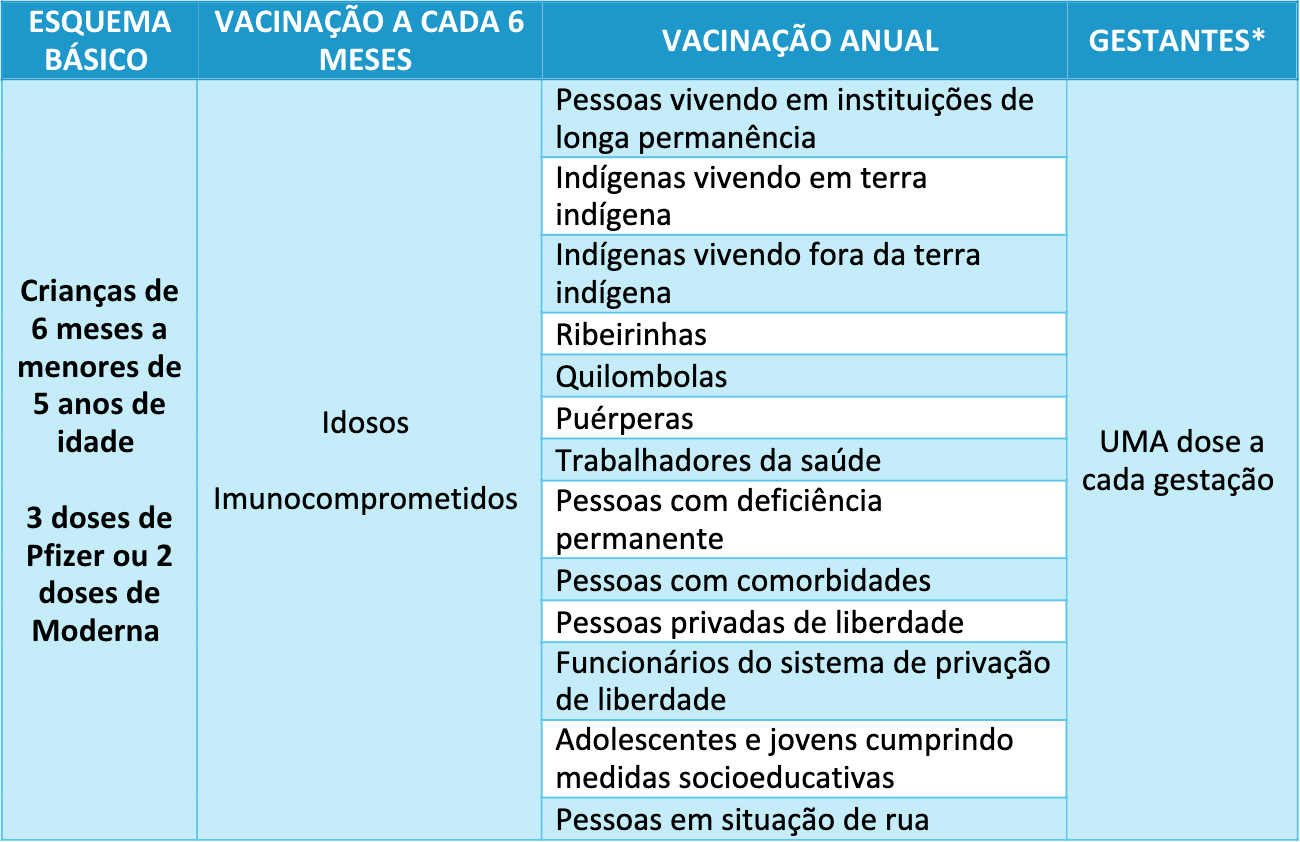
*Vacinar no puerpério o mais precoce possível as gestantes que perderam a oportunidade durante a gestação.
Adaptado de Ministério da Saúde²⁹,³⁰.
Deve-se sempre observar a vacina disponível para adequar o esquema de vacinação e doses em cada situação. No país há três laboratórios produtores que possuem apresentações e indicações distintas em cada faixa etária, conforme a Tabela D³⁰.
Tabela D. Vacinas COVID-19 disponibilizadas pelo Programa Nacional de Imunizações
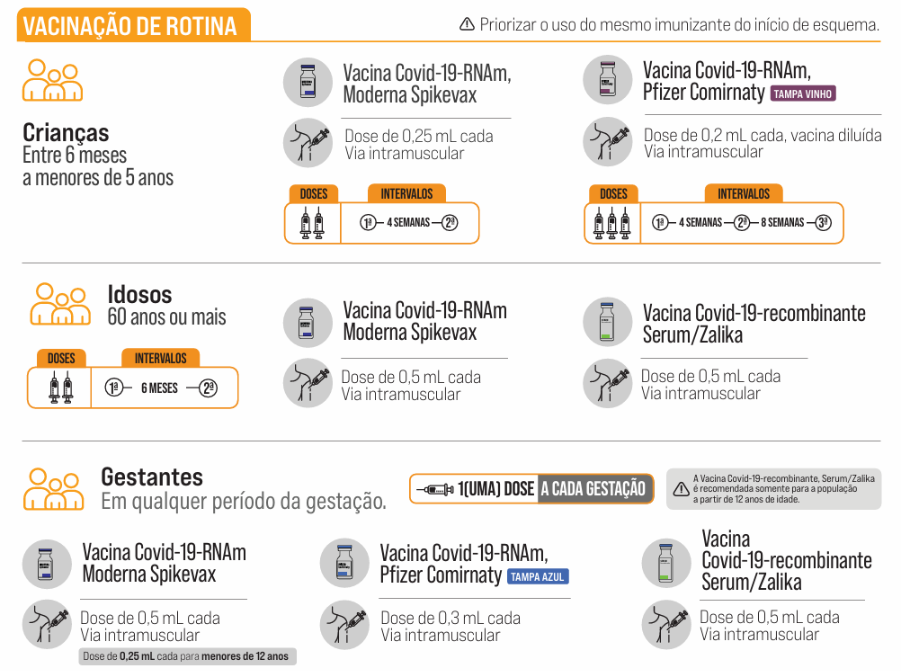
Adaptado de Ministério da Saúde³⁰.
Se um indivíduo acima de 5 anos que não tenha sido vacinado anteriormente (nenhuma dose prévia da vacina contra a covid-19) optar por realizar a vacinação, ele poderá receber uma dose de vacina disponível e recomendada para a sua faixa etária30. Quando a criança ou adolescente faz parte de algum grupo especial, torna-se importante verificar o esquema de vacinação prévio ou ausência de vacinação, para contemplar doses adicionais ou não, a depender da vacina utilizada e quando foi realizada²⁹.
Na Tabela E descreve-se quem são os contemplados em situações especiais para encaminhar para a vacinação²⁹.
Tabela E. CARACTERIZAÇÃO DE GRUPOS PRIORITÁRIOS
%20(1).png) *Considera-se pessoa com deficiência aquela que tem impedimento de longo prazo de natureza física, mental, intelectual ou sensorial, o qual, em interação com uma ou mais barreiras, pode obstruir sua participação plena e efetiva na sociedade em igualdade de condições com as demais pessoas. A condição "deficiência permanente" será autodeclarada.
*Considera-se pessoa com deficiência aquela que tem impedimento de longo prazo de natureza física, mental, intelectual ou sensorial, o qual, em interação com uma ou mais barreiras, pode obstruir sua participação plena e efetiva na sociedade em igualdade de condições com as demais pessoas. A condição "deficiência permanente" será autodeclarada.
Adaptado de Ministério da Saúde²⁹.
Como um exemplo desses grupos especiais, há a situação específica de imunocomprometidos apresentada na tabela F³¹.
Tabela F. Situação de vacinação com Comirnaty (Pfizer/BioNTech) em imunocomprometidos e esquema vacinal primário*.
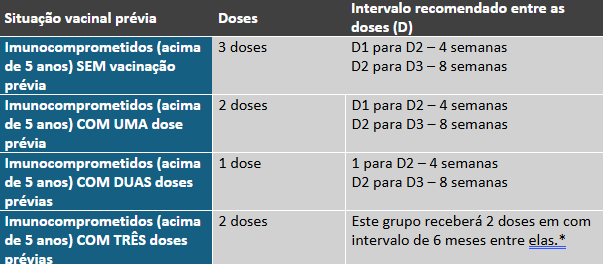
*Na eventual disponibilidade de vacinas atualizadas com novas cepas, o intervalo recomendado para administração será de 3 meses a partir da última dose recebida com a formulação anterior.
Adaptado de Secretaria da Saúde³¹.
Considerações finais
A Covid-19 continua representando um importante agravo à saúde em determinadas populações, incluindo crianças e adolescentes. As vacinas recomendadas na faixa pediátrica, da plataforma de mRNA, após extenso uso em diversos países, demonstram eficácia e um perfil de segurança e tolerabilidade adequados e são recomendadas pela SBP de acordo com os esquemas preconizados pelo Programa Nacional de imunizações (PNI) do Brasil ¹,²⁹ ³⁰.
Referências
- WORLD HEALTH ORGANIZATION. The COVID-19 pandemic and continuing challenges to global health. Disponível em: <https://www.who.int/about/funding/invest-in-who/investment-case-2.0/challenges>. Acesso em: 07 mai 2025.
- BARRETT, A. D. T. et al. The rapid progress in COVID vaccine development and implementation. npj Vaccines, v. 7, n. 1, 10 fev. 2022.
- FERNANDEZ, M. et al. Os motivos da hesitação vacinal no Brasil: uma análise a partir da percepção dos profissionais de saúde que atuaram na pandemia da COVID-19. Saúde Soc. São Paulo, v.33, n.4, e230854pt, 2024.
- WATSON, O. J. et al. Global impact of the first year of COVID-19 vaccination: a mathematical modelling study. The Lancet Infectious Diseases, v. 22, n. 9, p. 1293–1302, 23 jun. 2022.
- BEYRER, C. The long history of mRNA vaccines. Disponível em: <https://publichealth.jhu.edu/2021/the-long-history-of-mrna-vaccines>. Acesso em 02 jul. 2025.
- PARDI, N. et al. mRNA vaccines — a new era in vaccinology. Nat Rev Drug Discov. 2018 April ; 17(4): 261–279. doi:10.1038/nrd.2017.243.
- Blakney, Anna K., Shell Ip, and Andrew J. Geall. 2021. "An Update on Self-Amplifying mRNA Vaccine Development" Vaccines 9, no. 2: 97. https://doi.org/10.3390/vaccines9020097.
- ABBASI, J. COVID-19 and mRNA Vaccines—First Large Test for a New Approach. JAMA, v. 324, n. 12, 3 set. 2020.
- Qin S, Tang X, Chen Y, Chen K, Fan N, Xiao W, Zheng Q, Li G, Teng Y, Wu M, Song X. mRNA-based therapeutics: powerful and versatile tools to combat diseases. Signal Transduct Target Ther. 2022 May 21;7(1):166. doi: 10.1038/s41392-022-01007-w. PMID: 35597779;.
- Ministério da Saúde. Esquemas Vacinais. Disponível em: <https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/c/covid-19/esquemas-vacinais>. Acesso em: 07 mai 2025.
- Our World in Data. Total COVID-19 vaccine doses administered. Disponível em: <https://ourworldindata.org/grapher/cumulative-covid-vaccinations?country=BGD~BRA~CHN~IND~IDN~MEX~NGA~PAK~RUS~USA~OWID_WRL>. Acesso em 23 jun 2025.
- Ministério da Saúde. Vacinômetro COVID-19. Disponível em: <https://infoms.saude.gov.br/extensions/SEIDIGI_DEMAS_Vacina_C19/SEIDIGI_DEMAS_Vacina_C19.html>. Acesso em: 02 fev 2025.
- Ministério da Saúde. Boletim Epidemiológico No 146- Boletim COE Coronavírus. Disponível em: <https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/covid-19/2022/boletim-epidemiologico-no-146-boletim-coe-coronavirus/view>. Acesso em 28 mai. 2025
- Sociedade Brasileira de Pediatria. Vacinas COVID-19 em crianças no Brasil: Uma questão prioritária de saúde pública. Disponível em: <https://www.sbp.com.br/fileadmin/user_upload/23325b-NA_Vacinas_COVID-19_em_crc_no_BR_Uma_questao_prioritaria_SaudePubl.pdf>. Acesso em 03 mar. 2025.
- Saúde Brasil 2023. Análise da situação de saúde com enfoque nas crianças brasileiras. Disponível em: https://svs.aids.gov.br/daent/centrais-de-conteudos/publicacoes/saude-brasil/saude-brasil-2023-analise-da-situacao-de-saude-com-enfoque-nas-criancas-brasileiras.pdf. Acesso em: 02 fev 2025.
- MADNI, S. A. et al. COVID-19 Vaccine Reactogenicity Among Young Children. JAMA Network Open, v. 7, n. 11, p. e2447492, 25 nov. 2024.
- Pfizer. Bula Comirnaty®JN.1. Bula para Profissionais de Saúde. Disponível em: https://www.pfizer.com.br/bulas/comirnaty. Acesso em: 02 fev 2025.
- Adium S.A. SPIKEVAX (vacina covid-19). Disponível em: https://adium.com.br/wp-content/uploads/sites/3/2023/03/BU_VP_-Spikevax-XBB.1.5_0062-2_site.pdf Acesso em: 08 fev 2025.
- WORLD HEALTH ORGANIZATION. COVID-19 vaccine tracker and landscape. Disponível em: <https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines>. Acesso em 02 jul. 2025.
- ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. Manual de vigilância de eventos supostamente atribuíveis à vacinação ou imunização na Região das Américas. Washington, D.C.: OPAS, 2021. Disponível em: https://iris.paho.org/handle/10665.2/55946. Acesso em: 1 jul. 2025
- Heymans, S., Cooper, L.T. Myocarditis after COVID-19 mRNA vaccination: clinical observations and potential mechanisms. Nat Rev Cardiol 19, 75–77 (2022). https://doi.org/10.1038/s41569-021-00662-w.
- Sociedade Brasileira de Pediatria. Documento científico. DC Imunizações. Atualização vacinas covid-19 na Pediatria. n° 168 - 10/07/2024. Acesso em: 05 fev 2025.
- Patone, M. et al. Risk of myocarditis after sequential doses of COVID-19 vaccine and SARS-CoV-2 infection by age and sex. Circulation 146, 743–754 (2022).
- COPLAND, E. et al. Author Correction: Safety outcomes following COVID-19 vaccination and infection in 5.1 million children in England. Nature Communications, v. 15, n. 1, 8 jul. 2024.
- Supplementary Online Content. Buchan SA, Seo CY, Johnson C, et al. Epidemiology of myocarditis and pericarditis following mRNA vaccination by vaccine product, schedule, and interdose interval among adolescents and adults in Ontario, Canada. JAMA Netw Open. 2022;5(6):e2218505. doi:10.1001/jamanetworkopen.2022.18505.
- Ministério da Saúde. NOTA TÉCNICA Nº 22/2022-SECOVID/GAB/SECOVID/MS. Disponível em: <https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/notas-tecnicas/2022/nota-tecnica-22-2022-consolidacao-dos-esquemas-vacinais-da-populacao-acima-de-12-anos.pdf>
- Sociedade Brasileira de Pediatria. Documentos científicos. Imunizações. Miocardite e Pericardite após vacina COVID-19: Qual o Risco? Acesso restrito. Disponível em: https://www.sbp.com.br/imprensa/detalhe/nid/miocardite-e-pericardite-apos-vacina-covid-19-qual-o-risco/. Acesso em 05 fev 2025.
- LIKO, J.; CIESLAK, P. R. Assessment of Risk for Sudden Cardiac Death Among Adolescents and Young Adults After Receipt of COVID-19 Vaccine — Oregon, June 2021–December 2022. MMWR. Morbidity and Mortality Weekly Report, v. 73, n. 14, p. 317–320, 11 abr. 2024.
- Ministério da Saúde. Estratégia de vacinação contra a covid-19. 2ª edição. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/c/covid-19/publicacoes-tecnicas/guias-e-planos/estrategia-de-vacinacao-contra-a-covid-19-2024-2a-edicao>. Acesso em 25 jun 2025.
- Ministério da Saúde. Guia Rápido de Vacinação contra a Covid-19. Disponível em: <https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/guias-e-manuais/2024/guia-rapido-de-vacinacao-contra-a-covid-19.pdf/view>. Acesso em: 02 jul. 2025.
- Secretaria da Saúde. Documento Técnico. Estratégia de vacinação contra a COVID-19. 3ª edição. Disponível em: <https://www.saude.sp.gov.br/resources/cve-centro-de-vigilancia-epidemiologica/areas-de-vigilancia/imunizacao/2025/doctecnico06jan25_estrategia_vacinacao_covid19_vacinaxbb_3edicao.pdf>. Acesso em 02 jul. 2025.


Escrito por MDHealth
Biografia
A MDHealth é pioneira como a primeira empresa de educação médica independente no Brasil e na América Latina. Seu propósito é ampliar o acesso à informação e capacitação para profissionais e empresas da área da saúde. Com uma abordagem inovadora, a MDHealth oferece conteúdo de alta qualidade, alinhado com a agilidade do aprendizado rápido essencial no contexto da saúde atual. A empresa se posiciona como a ponte entre o conhecimento e a prática, conectando profissionais com informações atualizadas e relevantes. Na MDHealth, acredita-se que saúde e educação são pilares essenciais da sociedade, moldando o mundo em que vivemos. Por isso, a empresa dedica seus esforços diários para promover a interseção entre esses dois campos, contribuindo para o avanço da medicina e o bem-estar de todos.



